| 内部学习交流会之2015年度药品注册法规回顾 |
发布时间:2016-3-2
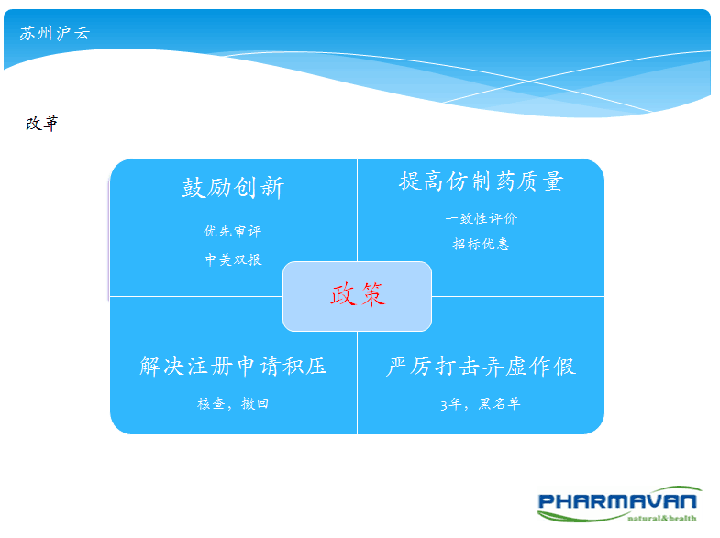
2015年医药界发生了很大的变化,CFDA和CDE等部门接连发布了关于药品注册的多条政策法规和技术指导原则,其中不乏仿制药一致性评价(BE备案制)、上市许可人制度试点、解决注册申请积压、打击弄虚作假等业界关注的热点话题。
2016年2月25日,我公司注册部牵头举办了内部交流学习会,由鱼刚对其中某些重点法规结合媒体或业内专家学者的看法进行了解读,其中包括国务院印发《关于改革药品医疗器械审评审批制度的意见》(国发﹝2015﹞44号)、《关于征求药品上市许可持有人制度试点方案和化学药品注册分类改革工作方案两个征求意见稿意见的公告》、《国家食品药品监督管理总局关于药品注册审评审批若干政策的公告(2015年第230号)》、《总局关于解决药品注册申请积压实行优先审评审批的意见(食药监药化管〔2016〕19号)》等与创新药研发息息相关的政策进行了梳理和宣贯;同时对2015年度全国的药品注册(新药、仿制药、生物药、进口药)受理、承办、审结批准、撤回、不批准情况采用图表形式进行了统计和分析。
另外,鱼刚还对创新药中美双报的注意点进行了阐述,尤其强调项目组要制定整体规划和严谨的方案,运用好外部专家顾问,做好风险预判,同时合理采用优先审评、加速审批、快速通道等申报策略,适时与FDA交流沟通。交流会还对2015年度热点话题进行了讨论,如数据完整性(飞检)、临床自查、集中审评、新版中国药典、屠呦呦、放开药价、精准医疗、分级诊疗、各省份招投标政策、国内外并购情况等。
   |